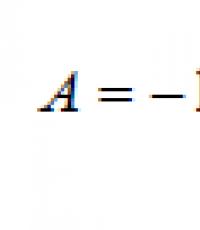Electron non apparié. L'essence des processus d'ionisation et d'excitation des atomes Le processus d'ionisation d'électrons non appariés
L'intérêt pratique de ce rapport réside dans le fait que connaissant μ, qui est relativement facile à mesurer, il est possible de déterminer D,
ce qui est assez difficile à déterminer directement.
Diffusion ambipolaire
Les électrons et les ions diffusent dans le plasma à décharge gazeuse. Le processus de diffusion est le suivant. Les électrons à mobilité plus élevée diffusent plus rapidement que les ions. Pour cette raison, un champ électrique est créé entre les électrons et les ions positifs en retard. Ce champ inhibe la diffusion des électrons, et vice versa, accélère la diffusion des ions. Lorsque les ions sont attirés vers les électrons, le champ électrique indiqué s'affaiblit et les électrons sont à nouveau détachés des ions. Ce processus est en cours. Cette diffusion est appelée diffusion ambipolaire, dont le coefficient est
D amb \u003d |
D e μ et + D et μ e |
|||
μ e + μ et |
||||
où D e, D et |
- coefficients de diffusion des électrons et des ions; μ e, μ et - |
|||
mobilité des électrons et des ions. |
||||
Puisque D e \u003e\u003e D u et μ e \u003e\u003e μ u, il s'avère que |
D иμ е≈ D e μ и, |
|||
donc D amb ≈ 2D u. Une telle diffusion a lieu, par exemple, dans la colonne positive d'une décharge luminescente.
1.6. Excitation et ionisation d'atomes et de molécules
On sait qu'un atome se compose d'un ion positif et d'électrons, dont le nombre est déterminé par le numéro de l'élément dans le tableau périodique de D.I. Mendeleev. Les électrons dans un atome sont à certains niveaux d'énergie. Si l'électron reçoit de l'énergie de l'extérieur, il passe à un niveau supérieur, appelé le niveau d'excitation.
Habituellement, un électron est au niveau d'excitation pendant une courte période, de l'ordre de 10-8 s. Lorsqu'un électron reçoit une énergie significative, il s'éloigne du noyau à une si grande distance qu'il peut perdre sa connexion avec lui et devient libre. Les électrons de valence sont les moins liés au noyau, qui sont à des niveaux d'énergie plus élevés et se détachent donc plus facilement de l'atome. Le processus de détachement d'un électron d'un atome s'appelle l'ionisation.
En figue. 1.3 montre l'image énergétique d'un électron de valence dans un atome. Ici W o est le niveau du sol d'un électron, W mst est un métastable
niveau, W 1, W 2 - niveaux d'excitation (premier, deuxième, etc.).
Partie I. Chapitre 1. Processus électroniques et ioniques dans une décharge de gaz
Figure: 1.3. Image énergétique d'un électron dans un atome
W ′ \u003d 0 est un état lorsqu'un électron perd sa liaison avec un atome. La quantité W et \u003d W ′ - W o est
avec de l'énergie d'ionisation. Les valeurs des niveaux indiqués pour certains gaz sont données dans le tableau. 1.3.
Le niveau métastable est caractérisé par le fait que les transitions d'électrons vers et depuis celui-ci sont interdites. Ce niveau est rempli de la soi-disant interaction d'échange, lorsqu'un électron de l'extérieur atterrit au niveau W mst, et l'excès
l'électron quitte l'atome. Les niveaux métastables jouent un rôle important dans les processus se produisant dans le plasma à décharge, car au niveau normal d'excitation, l'électron est pendant 10-8 s et au niveau métastable - 10-2 ÷ 10-3 s.
Tableau 1.3
Énergie, eV |
CO2 |
||||||||
W mst |
|||||||||
Le processus d'excitation des particules atomiques détermine également l'ionisation par le biais du phénomène dit de diffusion du rayonnement de résonance. Ce phénomène consiste dans le fait qu'un atome excité, passant dans un état normal, émet un quantum de lumière, qui excite l'atome suivant, et ainsi de suite. La région de diffusion du rayonnement de résonance est déterminée par le libre parcours moyen des photons λ ν, qui dépend
tamis sur la densité des particules atomiques n. Donc, pour n \u003d 1016 cm-3 λ ν \u003d 10-2 ÷ 1
voir Le phénomène de diffusion du rayonnement de résonance est également déterminé par la présence de niveaux métastables.
L'ionisation par étapes peut se produire selon différents schémas: a) le premier électron ou photon produit l'excitation d'un neutre
particule, et le deuxième électron ou photon confère une énergie supplémentaire à l'électron de valence, provoquant l'ionisation de cette particule neutre;
Partie I. Chapitre 1. Processus électroniques et ioniques dans une décharge de gaz
atome, et à ce moment l'atome excité passe dans l'état normal et émet un quantum de lumière, ce qui augmente l'énergie
c) enfin, deux atomes excités sont proches l'un de l'autre. Dans ce cas, l'un d'eux passe à l'état normal et émet un quantum de lumière, qui ionise le deuxième atome.
Il est à noter que l'ionisation par étapes devient efficace lorsque la concentration d'électrons rapides (avec des énergies proches de
à W et), les photons et les atomes excités sont suffisamment grands. C'est
c'est là que l'ionisation devient suffisamment intense. À leur tour, les photons incidents sur les atomes et les molécules peuvent également produire une excitation et une ionisation (directe ou par étapes). La source de photons dans une décharge gazeuse est le rayonnement d'une avalanche d'électrons.
1.6.1. Excitation et ionisation de molécules
Pour les gaz moléculaires, il est nécessaire de prendre en compte la possibilité d'exciter les molécules elles-mêmes, qui, contrairement aux atomes, effectuent des mouvements de rotation et de vibration. Ces mouvements sont également quantifiés. L'énergie du saut pendant le mouvement de rotation est de 10-3 ÷ 10-1 eV, et pendant le mouvement vibratoire - 10-2 ÷ 1 eV.
Dans la collision élastique d'un électron avec un atome, l'électron perd non-
beaucoup de votre énergie |
W \u003d 2 |
≈ 10 |
- 4 W. En cas de |
|||
rhénium d'un électron avec une molécule, l'électron excite le mouvement rotationnel et vibrationnel des molécules. Dans ce dernier cas, l'électron perd une énergie particulièrement importante jusqu'à 10-1 ÷ 1 eV. Par conséquent, l'excitation des mouvements vibrationnels des molécules est un mécanisme efficace pour extraire l'énergie d'un électron. En présence d'un tel mécanisme, l'accélération de l'électron est entravée et un champ plus fort est nécessaire pour que l'électron gagne une énergie suffisante pour l'ionisation. Par conséquent, le claquage d'un gaz moléculaire nécessite une tension plus élevée que le claquage d'un gaz atomique (inerte) à une distance interélectrode égale et une pression égale. Ceci est démontré par les données du tableau. 1.4, où la comparaison des valeurs λ t, S t et U pr atome
et les gaz moléculaires à la pression atmosphérique et d \u003d 1,3 cm.
Partie I. Chapitre 1. Processus électroniques et ioniques dans une décharge de gaz
Tableau 1.4 |
||||||||||
Caractéristique |
Nom du gaz |
|||||||||
S t 10 à 16, cm2 |
||||||||||
U pr, kV |
||||||||||
De la table. 1.4 on voit que bien que les sections efficaces de transport S t pour une molécule
l'argon et l'argon sont comparables, cependant, la tension de claquage de l'argon est beaucoup plus faible.
1.7. Ionisation thermique
À des températures élevées, une ionisation de gaz peut se produire en raison d'une augmentation de l'énergie cinétique des particules atomiques, appelée ionisation thermique. Ainsi, pour les vapeurs de Na, K, Cs, l'ionisation thermique est significative à une température de plusieurs milliers de degrés, et pour l'air à une température d'environ 104 degrés. La probabilité d'ionisation thermique augmente avec l'augmentation de la température et la diminution du potentiel d'ionisation des atomes (molécules). Aux températures ordinaires, l'ionisation thermique est négligeable et ne peut pratiquement avoir d'effet qu'avec le développement d'une décharge d'arc.
Cependant, il convient de noter que dès 1951, Hornbeck et Molnar ont découvert que lorsque des électrons monoénergétiques passent à travers des gaz inertes froids, les ions se forment à une énergie électronique suffisante uniquement pour l'excitation, mais pas pour l'ionisation des atomes. Ce processus s'appelait l'ionisation associative.
L'ionisation associative joue parfois un rôle important dans la propagation des ondes d'ionisation et des décharges d'étincelles dans des endroits où il y a encore très peu d'électrons. Des atomes excités s'y forment à la suite de l'absorption de quanta de lumière émergeant de régions déjà ionisées. Dans l'air modérément chauffé, à des températures de 4000-8000 K, les molécules sont suffisamment dissociées, mais il y a encore trop peu d'électrons pour le développement d'une avalanche. Dans ce cas, le principal mécanisme d'ionisation est une réaction à laquelle participent des atomes de N et d'O non excités.
L'ionisation associative se déroule selon le schéma suivant N + O + 2. 8 eV ↔ NO + + q. L'énergie manquante de 2,8 eV provient de l'énergie cinétique du mouvement relatif des atomes.
Les découvertes de la radioactivité ont confirmé la complexité de la structure non seulement des atomes, mais aussi de leurs noyaux. En 1903, E. Rutherford et F. Soddy ont proposé la théorie de la désintégration radioactive, qui a radicalement changé les anciennes vues sur la structure des atomes. Conformément à cette théorie, les éléments radioactifs se désintègrent spontanément avec la libération de particules α ou β et la formation d'atomes de nouveaux éléments chimiquement différents de ceux d'origine. Dans ce cas, la stabilité de la masse tant des atomes initiaux que de ceux formés à la suite du déroulement du processus de désintégration est préservée. E. Rutherford en 1919 a étudié pour la première fois la transformation artificielle des noyaux. Lors du bombardement d'atomes d'azote avec des particules α, il a libéré les noyaux des atomes d'hydrogène (protons) et des atomes du nucléide oxygène. De telles transformations sont appelées réactions nucléaires, car les noyaux d'atomes d'autres éléments sont obtenus à partir des noyaux d'atomes d'un élément. Les réactions nucléaires sont écrites à l'aide d'équations. Ainsi, la réaction nucléaire discutée ci-dessus peut s'écrire comme suit:
La définition du phénomène de radioactivité peut être donnée en utilisant le concept d'isotopes: la radioactivité est la transformation de noyaux instables d'atomes d'un élément chimique en noyaux d'atomes d'un autre élément, qui s'accompagne de la libération de particules élémentaires. La radioactivité qu'exposent les isotopes d'éléments qui existent dans la nature est appelée radioactivité naturelle. Le taux de transformations radioactives est différent pour différents isotopes. Il est caractérisé par une constante de désintégration radioactive, qui montre combien d'atomes d'un nucléide radioactif se désintègrent en 1 s. Il a été établi que le nombre d'atomes d'un nucléide radioactif qui se désintègre par unité de temps est proportionnel au nombre total d'atomes de ce nucléide et dépend de la valeur de la constante de désintégration radioactive. Par exemple, si pendant une certaine période la moitié du nombre total d'atomes d'un nucléide radioactif se désintègre, alors dans la période suivante, la moitié du résidu se désintègre, c'est-à-dire la moitié de celle de la période précédente, etc.
La durée de vie d'un nucléide radioactif est caractérisée par une demi-vie, c'est-à-dire une période de temps pendant laquelle la moitié de la quantité initiale de ce nucléide se désintègre. Par exemple, la demi-vie du radon est de 3,85 jours, celle du radium de 1620 ans et celle d'Uranus de 4,5 milliards d'années. De tels types de transformations radioactives sont connus: désintégration α, désintégration β, fission spontanée (auto-initiée) des noyaux. Ces types de transformations radioactives s'accompagnent de la libération de particules α, d'électrons, de positrons, de rayons γ. Dans le processus de désintégration α, le noyau d'un atome d'un élément radioactif libère le noyau d'un atome d'hélium, à la suite de quoi la charge du noyau d'un atome de l'élément radioactif d'origine diminue de deux unités et le nombre de masse de quatre. Par exemple, la transformation d'un atome de Radium en un atome de Radon peut être écrite par l'équation
![]()
La réaction nucléaire de désintégration β, qui s'accompagne de la libération d'électrons, de positrons ou de l'entraînement d'électrons orbitaux, peut également être écrite par l'équation
où e est un électron; hν est le quantum de rayon γ; ν o est un antineutrino (une particule élémentaire dont la masse au repos et la charge sont égales à zéro).
La possibilité de désintégration β est associée au fait que, conformément aux concepts modernes, un neutron peut se transformer dans certaines conditions en proton, libérant un électron et un antineutrino. Un proton et un neutron sont deux états d'une même particule nucléaire - un nucléon. Ce processus peut être représenté par le diagramme
Neutron -\u003e Proton + Electron + Antineutrino
Dans le processus de désintégration β des atomes d'un élément radioactif, l'un des neutrons, qui fait partie du noyau atomique, libère un électron et un antineutrino, se transformant en proton. Dans ce cas, la charge positive du noyau augmente de un. Ce type de désintégration radioactive est appelé désintégration électronique (β - désintégration). Ainsi, si le noyau d'un atome d'un élément radioactif libère une particule α, le noyau d'un atome d'un nouvel élément avec un nombre de protons de deux unités de moins est obtenu, et lorsqu'une particule β est libérée, un noyau d'un nouvel atome avec un numéro de proton supérieur de un à celui de l'original. C'est l'essence de la loi de déplacement de Soddy-Faience. Les noyaux atomiques de certains isotopes instables peuvent libérer des particules qui ont une charge positive de +1 et une masse proche de celle d'un électron. Cette particule s'appelle un positron. Donc, la conversion possible d'un proton en neutron selon le schéma:
Proton → Neutron + Positron + Neutrino
La transformation d'un proton en neutron n'est observée que lorsque l'instabilité du noyau est causée par l'excès de protons qu'il contient. Puis l'un des protons se transforme en neutron, et le positron et les neutrinos qui apparaissent dans ce cas volent hors du noyau; la charge du noyau diminue de un. Ce type de désintégration radioactive est appelé désintégration du positron (décroissance β +). Ainsi, en raison de la désintégration β du noyau d'un atome d'un élément radioactif, un atome d'un élément est obtenu qui est déplacé d'un endroit vers la droite (décroissance β) ou vers la gauche (décroissance β +) de l'élément radioactif d'origine. Une diminution de la charge nucléaire d'un atome radioactif peut être causée non seulement par la décroissance β +, mais aussi par la traînée d'électrons, à la suite de laquelle l'un des électrons de la boule d'électrons les plus proches du noyau est capturé par le noyau. Cet électron avec l'un des protons du noyau forme un neutron: e - + p → n
La théorie de la structure du noyau atomique a été développée dans les années 30 du XXe siècle. Les scientifiques ukrainiens D.D. Ivanenko et E.M. Gapon, ainsi que le scientifique allemand W. Heisenberg. Conformément à cette théorie, les noyaux des atomes sont composés de protons chargés positivement et de neutrons électriquement neutres. Les masses relatives de ces particules élémentaires sont à peu près les mêmes (la masse du proton est de 1,00728, la masse du neutron est de 1,00866). Les protons et les neutrons (nucléons) sont contenus dans le noyau par des forces nucléaires très fortes. Les forces nucléaires n'opèrent que sur de très petites distances - de l'ordre de 10 à 15 m.
L'énergie libérée lors de la formation d'un noyau à partir de protons et de neutrons est appelée énergie de liaison du noyau et caractérise sa stabilité.
Comme déjà mentionné, une paire d'électrons commune, qui réalise une liaison covalente, peut être formée en raison d'électrons non appariés présents dans des atomes en interaction non excités. Cela se produit, par exemple, lors de la formation de molécules telles que. Ici, chacun des atomes a un électron non apparié; lorsque deux de ces atomes interagissent, une paire d'électrons commune est créée - une liaison covalente apparaît.
Il y a trois électrons non appariés dans l'atome d'azote non excité:

Par conséquent, en raison d'électrons non appariés, l'atome d'azote peut participer à la formation de trois liaisons covalentes. Cela se produit, par exemple, dans des molécules ou, dans lesquelles la covalence de l'azote est de 3.
Cependant, le nombre de liaisons covalentes peut être supérieur au nombre d'électrons appariés disponibles dans un atome non excité. Ainsi, à l'état normal, la couche électronique externe d'un atome de carbone a une structure qui est représentée par le diagramme:

En raison des électrons non appariés disponibles, un atome de carbone peut former deux liaisons covalentes. Pendant ce temps, le carbone est caractérisé par des composés dans lesquels chacun de ses atomes est lié aux atomes voisins par quatre liaisons covalentes (par exemple, et ainsi de suite). Cela s'avère possible en raison du fait qu'avec la dépense d'une certaine énergie, l'un des électrons présents dans l'atome peut être transféré au sous-niveau, à la suite de quoi l'atome passe dans un état excité et le nombre d'électrons non appariés augmente. Un tel processus d'excitation, accompagné de la "vapeur" des électrons, peut être représenté par le schéma suivant, dans lequel l'état excité est marqué d'un astérisque au niveau du symbole de l'élément:

Il y a maintenant quatre électrons non appariés dans la couche d'électrons externe de l'atome de carbone; par conséquent, un atome de carbone excité peut participer à la formation de quatre liaisons covalentes. Dans ce cas, une augmentation du nombre de liaisons covalentes créées s'accompagne de la libération de plus d'énergie que celle dépensée pour transférer un atome vers un état excité.
Si l'excitation d'un atome, conduisant à une augmentation du nombre d'électrons non appariés, est associée à de très grandes dépenses d'énergie, alors ces dépenses ne sont pas compensées par l'énergie de formation de nouvelles liaisons; alors, un tel processus dans son ensemble se révèle énergétiquement défavorable. Ainsi, les atomes d'oxygène et de fluor n'ont pas d'orbitales libres dans la couche d'électrons externe:

Ici, une augmentation du nombre d'électrons non appariés n'est possible qu'en transférant l'un des électrons au niveau d'énergie suivant, c'est-à-dire à un état. Cependant, une telle transition est associée à une dépense d'énergie très importante, qui n'est pas couverte par l'énergie libérée lorsque de nouvelles liaisons apparaissent. Par conséquent, en raison d'électrons non appariés, un atome d'oxygène ne peut former plus de deux liaisons covalentes et un atome de fluor - une seule. En effet, ces éléments sont caractérisés par une covalence constante égale à deux pour l'oxygène et à une pour le fluor.
Les atomes des éléments de la troisième période et des périodes suivantes ont un sous-niveau dans la couche d'électrons externe, vers lequel, lors de l'excitation, les électrons s et p de la couche externe peuvent se transférer. Par conséquent, des possibilités supplémentaires pour augmenter le nombre d'électrons non appariés apparaissent ici. Ainsi, un atome de chlore, qui a un électron non apparié dans un état non excité,

peut être converti, au prix d'une certaine énergie, en états excités caractérisés par trois, cinq ou sept électrons non appariés;

Par conséquent, contrairement à l'atome de fluor, l'atome de chlore peut participer à la formation non seulement d'une, mais aussi de trois, cinq ou sept liaisons covalentes. Ainsi, dans l'acide chloreux, la covalence du chlore est de trois, dans l'acide chlorique - cinq et dans l'acide perchlorique - sept. De même, un atome de soufre, qui a également un sous-niveau β inoccupé, peut passer dans des états excités avec quatre ou six électrons non appariés et, par conséquent, participer à la formation non seulement de deux, comme dans l'oxygène, mais aussi de quatre ou six liaisons covalentes. Cela peut expliquer l'existence de composés dans lesquels le soufre présente une covalence de quatre ou six.
Dans de nombreux cas, des liaisons covalentes se produisent également en raison d'électrons appariés présents dans le champ électronique externe de l'atome. Considérons, par exemple, la structure électronique d'une molécule d'ammoniac:
Ici, les points indiquent les électrons qui appartenaient à l'origine à l'atome d'azote et les croix - ceux qui appartenaient aux atomes d'hydrogène. Sur les huit électrons externes de l'atome d'azote, six forment trois liaisons covalentes et sont communs à l'atome d'azote et aux atomes d'hydrogène. Mais deux électrons n'appartiennent qu'à l'azote et forment une seule paire d'électrons. Une telle paire d'électrons peut également participer à la formation d'une liaison covalente avec un autre atome, s'il existe une orbitale libre dans la couche d'électrons externe de cet atome. Un orbitale non rempli est présent, par exemple, dans un hydrogène non, qui est généralement dépourvu d'électrons:
Par conséquent, lorsqu'une molécule interagit avec un ion hydrogène, une liaison covalente se crée entre eux; la seule paire d'électrons de l'atome d'azote devient commune à deux atomes, entraînant la formation d'un ion ammonium:

Ici, une liaison covalente est née d'une paire d'électrons (paire d'électrons) et de l'orbitale libre d'un autre atome (accepteur d'une paire d'électrons) qui appartenait à l'origine à un atome (donneur d'une paire d'électrons).
Cette méthode de formation d'une liaison covalente est appelée donneur-accepteur. Dans l'exemple considéré, le donneur de la paire d'électrons est l'atome d'azote et l'accepteur est l'atome d'hydrogène.
L'expérience a établi que les quatre liaisons de l'ion ammonium sont équivalentes à tous égards. Il en résulte que la liaison formée par la méthode donneur-accepteur ne diffère pas dans ses propriétés de la liaison covalente créée par les électrons non appariés des atomes en interaction.
Un autre exemple de molécule dans laquelle il y a des liaisons formées par la méthode donneur-accepteur est la molécule d'oxyde nitrique.
Auparavant, la formule développée de ce composé était représentée comme suit:
Selon cette formule, l'atome d'azote central est connecté aux atomes voisins par cinq liaisons covalentes, de sorte qu'il y a dix électrons (cinq paires d'électrons) dans sa couche d'électrons externe. Mais cette conclusion contredit la structure électronique de l'atome d'azote, puisque sa couche L externe ne contient que quatre orbitales (une orbitale s et trois orbitales p) et ne peut pas contenir plus de huit électrons. Par conséquent, la formule structurelle donnée ne peut pas être considérée comme correcte.
Considérez la structure électronique de l'oxyde nitrique, et les électrons des atomes individuels seront alternativement désignés par des points ou des croix. L'atome d'oxygène, qui a deux électrons non appariés, forme deux liaisons covalentes avec l'atome d'azote central:
En raison de l'électron non apparié restant au niveau de l'atome d'azote central, ce dernier forme une liaison covalente avec le deuxième atome d'azote:
![]()
Ainsi, les couches électroniques externes de l'atome d'oxygène et de l'atome d'azote central sont remplies: ici, des configurations stables à huit électrons se forment. Mais dans la couche d'électrons externe de l'atome d'azote le plus externe, il n'y a que six électrons; cet atome peut donc être un accepteur d'encore une autre paire d'électrons. L'atome d'azote central voisin a une seule paire d'électrons et peut agir en tant que donneur.
Cela conduit à la formation d'une autre liaison covalente entre les atomes d'azote par la méthode donneur-accepteur:
![]()
Maintenant, chacun des trois atomes qui composent la molécule a une structure stable à huit électrons de la couche externe. Si la liaison covalente formée par la méthode donneur-accepteur est désignée, comme d'habitude, par une flèche dirigée de l'atome donneur vers l'atome accepteur, alors la formule structurale de l'oxyde nitrique (I) peut être représentée comme suit:
Ainsi, dans l'oxyde nitrique, la covalence de l'atome d'azote central est de quatre et l'extrême est de deux.
Les exemples considérés montrent que les atomes ont une variété de possibilités pour la formation de liaisons covalentes. Ce dernier peut être créé à la fois en raison d'électrons non appariés d'un atome non excité, et en raison d'électrons non appariés apparaissant à la suite de l'excitation d'un atome («désappariement» de paires d'électrons), et, enfin, par la méthode du donneur-accepteur. Cependant, le nombre total de liaisons covalentes qu'un atome donné peut former est limité. Il est déterminé par le nombre total d'orbitales de valence, c'est-à-dire les orbitales dont l'utilisation pour la formation de liaisons covalentes s'avère être énergétiquement favorable. Le calcul de la mécanique quantique montre que les orbitales s et p de la couche externe d'électrons et l'orbitale de la couche précédente appartiennent à de telles orbitales; dans certains cas, comme nous l'avons vu avec les exemples d'atomes de chlore et de soufre, les orbitales de valence peuvent également être utilisées dans les orbitales α de la couche externe.
Les atomes de tous les éléments de la deuxième période ont quatre orbitales dans la couche d'électrons externe, en l'absence d'orbitales dans la couche précédente. Par conséquent, pas plus de huit électrons peuvent être placés sur les orbitales de valence de ces atomes. Cela signifie que la covalence maximale des éléments de la deuxième période est de quatre.
Les atomes des éléments de la troisième période et des périodes suivantes peuvent être utilisés pour former des liaisons covalentes non seulement s- et, mais aussi -orbitales. Composés connus d'éléments dans lesquels la formation de liaisons covalentes implique les orbitales s et p de la couche d'électrons externe et les cinq orbitales de la couche précédente; dans de tels cas, la covalence de l'élément correspondant atteint neuf.
La capacité des atomes à participer à la formation d'un nombre limité de liaisons covalentes est appelée saturation de la liaison covalente.

Courant électrique dans les gaz.
Décharge électrique non auto-entretenue.L'expérience montre que deux plaques de charge opposée, séparées par une couche d'air, ne sont pas évacuées.
Habituellement, une substance à l'état gazeux est un isolant, car les atomes ou molécules qui la composent contiennent le même nombre de charges électriques négatives et positives et sont généralement neutres.
Amenons la flamme d'une allumette ou d'une lampe à alcool dans l'espace entre les assiettes (Fig. 164).
L'électromètre commencera à se décharger rapidement. Par conséquent, l'air sous l'influence de la flamme est devenu un conducteur. Lorsque la flamme est retirée de l'espace entre les plaques, la décharge de l'électromètre s'arrête. Le même résultat peut être obtenu en irradiant les plaques avec la lumière d'un arc électrique. Ces expériences prouvent que le gaz peut devenir conducteur de courant électrique.
Le phénomène du passage d'un courant électrique à travers un gaz, observé uniquement sous la condition d'une influence externe, est appelé décharge électrique non auto-entretenue.
Ionisation thermique.Le chauffage du gaz en fait un conducteur de courant électrique, car certains des atomes ou molécules du gaz sont convertis en ions chargés.
Pour détacher un électron d'un atome, il est nécessaire de travailler contre les forces d'attraction coulombienne entre un noyau chargé positivement et un électron négatif. Le processus de détachement d'un électron d'un atome s'appelle l'ionisation de l'atome. L'énergie minimale qui doit être dépensée pour détacher un électron d'un atome ou d'une molécule est appelée l'énergie de liaison.
Un électron peut être arraché à un atome lorsque deux atomes entrent en collision, si leur énergie cinétique dépasse l'énergie de liaison de l'électron. L'énergie cinétique du mouvement thermique des atomes ou des molécules est directement proportionnelle à la température absolue; par conséquent, à mesure que la température du gaz augmente, le nombre de collisions d'atomes ou de molécules accompagnées d'une ionisation augmente.
Le processus de formation d'électrons libres et d'ions positifs à la suite de collisions d'atomes et de molécules de gaz à des températures élevées est appelé ionisation thermique.
Plasma.Un gaz dans lequel une proportion importante d'atomes ou de molécules est ionisée est appelé un plasma. Le degré d'ionisation thermique du plasma dépend de la température. Par exemple, à une température de 10 000 K, moins de 10% du nombre total d'atomes d'hydrogène sont ionisés; à des températures supérieures à 20 000 K, l'hydrogène est presque complètement ionisé.
Les électrons et les ions du plasma peuvent se déplacer sous l'influence d'un champ électrique. Ainsi, à basse température, le gaz est un isolant, à haute température, il se transforme en plasma et devient un conducteur de courant électrique.
Photoionisation.L'énergie nécessaire pour détacher un électron d'un atome ou d'une molécule peut être transmise par la lumière. L'ionisation d'atomes ou de molécules par la lumière est appelée photoionisation.
Décharge auto-électrique... Avec une augmentation de l'intensité du champ électrique jusqu'à une certaine valeur définie, en fonction de la nature du gaz et de sa pression, un courant électrique se produit dans le gaz même sans l'influence d'ioniseurs externes. Le phénomène de passage d'un courant électrique à travers le gaz, indépendant de l'action des ioniseurs externes, est appelé décharge électrique indépendante.
Dans l'air à pression atmosphérique, une décharge électrique auto-entretenue se produit à une intensité de champ électrique d'environ
Le principal mécanisme d'ionisation de gaz dans une décharge électrique auto-entretenue est l'ionisation des atomes et des molécules due aux impacts d'électrons.
Ionisation par impact électronique.L'ionisation par impact d'électrons devient possible lorsque l'électron en libre parcours acquiert une énergie cinétique qui dépasse l'énergie de liaison W de l'électron avec l'atome.
L'énergie cinétique Wc de l'électron, acquise sous l'action d'un champ électrique de force, est égale au travail des forces du champ électrique:
où l est le libre chemin.
Par conséquent, la condition approximative pour le début de l'ionisation par impact électronique a la forme
L'énergie de liaison des électrons dans les atomes et les molécules est généralement exprimée en tensions électroniques (eV). 1 eV est égal au travail que fait le champ électrique lorsqu'un électron (ou une autre particule à charge élémentaire) se déplace entre les points du champ, dont la tension est de 1 V:
L'énergie d'ionisation d'un atome d'hydrogène, par exemple, est de 13,6 eV.
Mécanisme d'auto-décharge. Le développement d'une décharge électrique auto-entretenue dans un gaz se déroule comme suit. Un électron libre sous l'action d'un champ électrique acquiert une accélération. Si l'intensité du champ électrique est suffisamment élevée, l'électron libre augmente tellement l'énergie cinétique qu'il l'ionise lorsqu'il entre en collision avec une molécule.
Le premier électron, qui a provoqué l'ionisation de la molécule, et le deuxième électron libéré à la suite de l'ionisation, sous l'action du champ électrique acquièrent une accélération dans la direction de la cathode à l'anode. Chacun d'eux dans les prochaines collisions libère un électron de plus et le nombre total d'électrons libres devient égal à quatre. Puis, de la même manière, il augmente jusqu'à 8, 16, 32, 64, etc. Le nombre d'électrons libres passant de la cathode à l'anode augmente comme une avalanche jusqu'à atteindre l'anode (Fig. 165).
Les ions positifs générés dans le gaz se déplacent sous l'action d'un champ électrique de l'anode à la cathode. Lorsque des ions positifs frappent la cathode et sous l'action de la lumière émise lors de la décharge, de nouveaux électrons peuvent être libérés de la cathode. Ces électrons, à leur tour, sont accélérés par le champ électrique et créent de nouvelles avalanches électron-ion, de sorte que le processus peut se poursuivre en continu.
La concentration d'ions dans le plasma augmente avec le développement de la décharge auto-entretenue et la résistance électrique de l'espace de décharge diminue. L'intensité du courant dans le circuit d'autodécharge est généralement déterminée uniquement par la résistance interne de la source de courant et la résistance électrique des autres éléments du circuit.
Décharge d'étincelle. Foudre.Si la source de courant n'est pas en mesure de maintenir une décharge électrique auto-entretenue pendant une longue période, la décharge auto-entretenue qui se produit est appelée décharge par étincelle. La décharge par étincelle est interrompue peu de temps après le début de la décharge en raison d'une diminution significative de la tension. Des exemples de décharges d'étincelles sont les étincelles qui se produisent lors du brossage des cheveux, de la séparation de feuilles de papier ou de la décharge d'un condensateur.
La foudre observée lors d'un orage représente également une décharge électrique indépendante. L'intensité du courant dans le canal de la foudre atteint 10 000-20 000 A, la durée de l'impulsion de courant est de plusieurs dizaines de microsecondes. La décharge électrique indépendante entre le nuage d'orage et la Terre après plusieurs coups de foudre s'arrête d'elle-même, car la plupart des charges électriques en excès dans le nuage d'orage sont neutralisées par le courant électrique traversant le canal plasma de la foudre (Fig.166).
Avec une augmentation du courant dans le canal de la foudre, le plasma chauffe jusqu'à une température de plus de 10000 K.Les changements de pression dans le canal de plasma de la foudre avec une augmentation du courant et la fin de la décharge provoquent des phénomènes sonores appelés tonnerre.
Décharge luminescente... Au fur et à mesure que la pression de gaz dans l'espace de décharge diminue, le canal de décharge devient plus large, puis tout le tube à décharge est uniformément rempli du plasma incandescent. Ce type de décharge électrique auto-entretenue dans les gaz est appelée décharge luminescente (Fig. 167).
Arc électrique.Si l'intensité du courant dans une décharge de gaz auto-entretenue est très élevée, les impacts des ions positifs et des électrons peuvent provoquer un échauffement de la cathode et de l'anode. Des électrons sont émis par la surface de la cathode à une température élevée, ce qui assure le maintien d'une décharge auto-entretenue dans le gaz. Une décharge électrique auto-entretenue à long terme dans les gaz, maintenue par une émission thermo-ionique de la cathode, est appelée décharge d'arc (Fig. 168).
Décharge Corona.Dans les champs électriques très inhomogènes, formés, par exemple, entre un point et un plan ou entre un fil et un plan (ligne électrique), une décharge séparée d'un type spécial, appelée décharge corona, se produit. Dans une décharge corona, l'ionisation par impact électronique ne se produit qu'à proximité de l'une des électrodes, dans une région à forte intensité de champ électrique.
Application de décharges électriques. Les impacts d'électrons accélérés par un champ électrique conduisent non seulement à l'ionisation des atomes et des molécules du gaz, mais aussi à l'excitation des atomes et des molécules, accompagnée de l'émission de lumière. Le rayonnement lumineux d'un plasma à décharge électrique auto-entretenu est largement utilisé dans l'économie nationale et dans la vie quotidienne. Il s'agit de lampes fluorescentes et de lampes à décharge pour l'éclairage public, d'un arc électrique dans un appareil de projection de cinéma et de lampes au mercure-quartz utilisées dans les hôpitaux et les cliniques.
La température élevée du plasma à décharge d'arc permet de l'utiliser pour la découpe et le soudage de structures métalliques, pour la fusion des métaux. À l'aide d'une décharge d'étincelle, les pièces fabriquées avec les matériaux les plus durs sont traitées.
Une décharge électrique dans les gaz est également un phénomène indésirable qui doit être traité par la technologie. Par exemple, la décharge corona des fils de lignes électriques à haute tension entraîne des pertes d'électricité inutiles. L'augmentation de ces pertes avec l'augmentation de la tension limite la manière d'augmenter encore la tension dans la ligne électrique, tandis que pour réduire les pertes d'énergie pour chauffer les fils, une telle augmentation est hautement souhaitable.
Recombinaison.
La recombinaison est l'inverse de l'ionisation. Il consiste en la capture d'un électron libre par un ion. La recombinaison conduit à une diminution de la charge d'un ion ou à la conversion d'un ion en un atome ou une molécule neutre. La recombinaison d'un électron et d'un atome neutre (molécule) est également possible, conduisant à la formation d'un ion négatif, et dans des cas plus rares, à la recombinaison d'un ion négatif avec la formation d'un ion négatif chargé deux ou trois fois. Au lieu d'un électron, dans certains cas, d'autres particules élémentaires peuvent agir, par exemple, des mésons, créant des mésoatomes ou des mésomolécules. Dans les premiers stades du développement de l'univers, une réaction de recombinaison d'hydrogène a eu lieu.
La recombinaison est le processus inverse de rupture d'une liaison chimique. La recombinaison est associée à la formation d'une liaison covalente ordinaire due au partage d'électrons non appariés appartenant à différentes particules (atomes, radicaux libres)
Exemples de recombinaison:
H + H → H2 + Q;
Cl + Cl → Cl2 + Q;
CH3 + CH3 → C2H6 + Q, etc.
Electrons appariés
S'il y a un électron dans l'orbitale, alors il est appelé non apparié et si deux - alors ce électrons appariés.
Quatre nombres quantiques n, l, m, m s caractérisent pleinement l'état énergétique d'un électron dans un atome.
Compte tenu de la structure de la couche électronique d'atomes à plusieurs électrons de divers éléments, il est nécessaire de prendre en compte trois points principaux:
· le principe de Pauli,
Le principe de la moindre énergie,
La règle de Gund.
Selon principe de Pauli un atome ne peut pas avoir deux électrons avec les mêmes valeurs des quatre nombres quantiques.
Le principe de Pauli détermine le nombre maximum d'électrons dans une orbitale, un niveau et un sous-niveau. Puisque AO est caractérisé par trois nombres quantiques n, l, m, alors les électrons d'une orbitale donnée ne peuvent différer que par le nombre quantique de spin sP... Mais le nombre quantique de spin sPne peut avoir que deux valeurs + 1/2 et - 1/2. Par conséquent, dans une orbitale, il ne peut y avoir plus de deux électrons avec des valeurs différentes des nombres quantiques de spin.
Figure: 4.6. La capacité maximale d'une orbitale est de 2 électrons.
Le nombre maximum d'électrons au niveau d'énergie est défini comme 2 n 2, et au sous-niveau - comme 2 (2 l + 1). Le nombre maximum d'électrons situés à différents niveaux et sous-niveaux est donné dans le tableau. 4.1.
Tableau 4.1.
Nombre maximal d'électrons aux niveaux et sous-niveaux quantiques
| Niveau d'énergie | Sous-niveau énergétique | Valeurs possibles du nombre quantique magnétique m | Le nombre d'orbitales par | Le nombre maximum d'électrons par | ||
| sous-niveau | niveau | sous-niveau | niveau | |||
| K (n=1) | s (l=0) | |||||
| L (n=2) | s (l=0) p (l=1) | –1, 0, 1 | ||||
| M (n=3) | s (l=0) p (l=1) ré (l=2) | –1, 0, 1 –2, –1, 0, 1, 2 | ||||
| N (n=4) | s (l=0) p (l=1) ré (l=2) f (l=3) | –1, 0, 1 –2, –1, 0, 1, 2 –3, –2, –1, 0, 1, 2, 3 |
La séquence de remplissage des orbitales avec des électrons est effectuée conformément à le principe de la moindre énergie .
Selon le principe de moindre énergie, les électrons remplissent les orbitales par ordre d'énergie croissante.
L'ordre de remplissage des orbitales est déterminé règle de Klechkovsky: une augmentation d'énergie et, en conséquence, le remplissage des orbitales se produit dans l'ordre croissant de la somme des nombres quantiques principal et orbital (n + l), et avec une somme égale (n + l) - dans l'ordre croissant du nombre quantique principal n.
Par exemple, l'énergie d'un électron au sous-niveau 4s est inférieure à celle du 3 ré, puisque dans le premier cas la somme n + l \u003d 4 + 0 \u003d 4 (rappelez-vous que pour s-valeur de niveau supérieur du nombre quantique orbital l\u003d \u003d 0), et dans la seconde n + l \u003d 3 + 2 \u003d 5 ( ré - sous-niveau, l\u003d 2). Par conséquent, le premier sous-niveau 4 est rempli spuis 3 ré (voir la figure 4.8).
Sur les sous-niveaux 3 ré (n = 3, l = 2) , 4r (n = 4, l \u003d 1) et 5 s (n = 5, l \u003d 0) la somme des valeurs p et l sont identiques et égaux à 5. En cas d'égalité des valeurs des sommes n et ld'abord le sous-niveau avec la valeur minimale est rempli n, c'est à dire. sous-niveau 3 ré.
Conformément à la règle de Klechkovsky, l'énergie des orbitales atomiques augmente dans l'ordre suivant:
1s < 2s < 2r < 3s < 3r < 4s < 3ré < 4r < 5s < 4ré < 5p < 6s < 5ré »
"4 f < 6p < 7s….
Selon le sous-niveau de l'atome rempli au dernier tour, tous les éléments chimiques sont divisés en 4 familles électroniques : éléments s, p, d, f.
 4f
4f
4 4j
3 4 s
3p
3s
1 2s
Niveaux de sous-niveau
Figure: 4.8. Énergie des orbitales atomiques.
Les éléments dans les atomes desquels le sous-niveau s du niveau extérieur est rempli en dernier sont appelés éléments s ... Avoir s-les éléments de valence sont des s-électrons du niveau d'énergie externe.
Avoir éléments p le dernier est le sous-niveau p du niveau externe. Leurs électrons de valence sont situés sur p- et s-sous-niveaux du niveau externe. Avoir ré-les derniers éléments sont remplis ré-sublevel du niveau pré-externe et la valence sont s-électrons de l'extérieur et ré- électrons de niveaux d'énergie pré-externes.
Avoir éléments f dernier rempli f- sous-niveau du troisième niveau d'énergie à l'extérieur.
L'ordre de placement des électrons dans un sous-niveau est déterminé la règle de Gund:
dans le sous-niveau, les électrons sont placés de telle manière que la somme de leurs nombres quantiques de spin ait une valeur maximale en valeur absolue.
En d'autres termes, les orbitales de ce sous-niveau sont remplies d'abord par un électron avec le même nombre quantique de spin, puis par le second électron avec la valeur opposée.
Par exemple, s'il est nécessaire de distribuer 3 électrons dans trois cellules quantiques, alors chacun d'eux sera situé dans une cellule séparée, c'est-à-dire occupent une orbitale distincte:
∑sP= ½ – ½ + ½ = ½.
L'ordre dans lequel les électrons sont répartis sur les niveaux d'énergie et les sous-niveaux dans la coquille d'un atome s'appelle sa configuration électronique, ou formule électronique. Maquillage configuration électronique nombre niveau d'énergie (nombre quantique principal) sont désignés par les nombres 1, 2, 3, 4 ..., sous-niveau (nombre quantique orbital) - par des lettres s, p, ré, f... Le nombre d'électrons sur un sous-niveau est indiqué par un nombre qui est écrit en haut du symbole de sous-niveau.
La configuration électronique d'un atome peut être décrite comme le soi-disant formule graphique électronique... Il s'agit d'un diagramme du placement des électrons dans les cellules quantiques, qui sont une représentation graphique d'une orbitale atomique. Chaque cellule quantique ne peut pas contenir plus de deux électrons avec des valeurs différentes des nombres quantiques de spin.
Pour élaborer une formule électronique ou graphique électronique pour n'importe quel élément, il faut savoir:
1. Le nombre ordinal de l'élément, c'est-à-dire la charge de son noyau et le nombre d'électrons correspondant dans l'atome.
2. Le numéro de la période, qui détermine le nombre de niveaux d'énergie de l'atome.
3. Les nombres quantiques et la relation entre eux.
Ainsi, par exemple, un atome d'hydrogène avec le numéro de série 1 a 1 électron. L'hydrogène est un élément de la première période, donc le seul électron est situé au premier niveau d'énergie sest l'orbitale avec l'énergie la plus basse. La formule électronique de l'atome d'hydrogène sera:
1 heure 1 s 1 .
La formule graphique électronique de l'hydrogène ressemblera à:
Formules électroniques et graphiques électroniques de l'atome d'hélium:
2 pas 1 s 2
2 pas 1 s
reflètent l'intégralité de la coque électronique, qui détermine sa stabilité. L'hélium est un gaz rare caractérisé par une résistance chimique élevée (inertie).
L'atome de lithium 3 Li a 3 électrons, c'est un élément de la période II, ce qui signifie que les électrons sont situés à 2 niveaux d'énergie. Deux électrons se remplissent s - sous-niveau du premier niveau d'énergie et le 3ème électron est situé sur s - sous-niveau du deuxième niveau d'énergie:
3 Li 1 s 2 2s 1
Valence I
L'atome de lithium a un électron situé en 2 s-sublevel, est moins fermement lié au noyau que les électrons du premier niveau d'énergie, par conséquent, dans les réactions chimiques, un atome de lithium peut facilement donner cet électron, se transformant en un ion Li + ( et il - particule chargée électriquement ). Dans ce cas, l'ion lithium acquiert une enveloppe complète stable de l'hélium noble gazeux:
3 Li + 1 s 2 .
Il convient de noter que, le nombre d'électrons non appariés (simples) déterminevalence d'élément , c'est à dire. sa capacité à former des liaisons chimiques avec d'autres éléments.
Ainsi, un atome de lithium a un électron non apparié, ce qui détermine sa valence égale à un.
La formule électronique de l'atome de béryllium:
4 Soyez 1s 2 2s 2.
Formule électronique-graphique de l'atome de béryllium:
2 Valence est principalement
L'état est 0
Le béryllium perd des électrons du sous-niveau 2 plus facilement que les autres. s 2, formant l'ion Be +2:
On peut noter que l'atome d'hélium et les ions lithium 3 Li + et béryllium 4 Be +2 ont la même structure électronique, c'est-à-dire caractérisé par structure isoélectronique.